Régulation des fonctions effectrices des lymphocytes T
Responsable(s)
Nous effectuons un type exploratoire de recherche fondamentale qui vise à la meilleure compréhension de la contribution des interactions entre les lymphocytes T et leur environnement dans le maintien de la tolérance immunitaire et la capacité du système immunitaire à monter des réponses efficaces dans diverses conditions pathologiques. En particulier, nos projets s’intéressent à la régulation des réponses des lymphocytes T aux antigènes du soi au “steady state” et dans le contexte du cancer. Notre objectif ultime est d'identifier les acteurs moléculaires et cellulaires clés modulant la fonction et la différenciation des lymphocytes T et de caractériser les mécanismes impliqués.
Plus précisément, les principales thématiques développées dans notre équipe sont les suivantes :
- Ontogénie et fonctions des cellules T CD4 régulatrices périphériques au “steady state” et dans le contexte du cancer (C. Auffray)
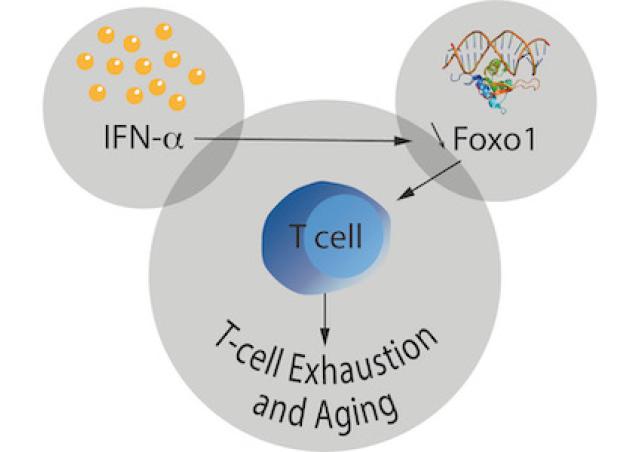
- Rôle du facteur de transcription Foxo1 dans les fonctions des lymphocytes T et l’immunosénescence (B. Lucas)
- Le fer comme adjuvant des réponses anti-tumorales (B. Martin)
Pour mener à bien ces projets, nous combinons modèles animaux, cytométrie multiparamétrique, imagerie et génomique.