Bactéries et périnatalité
Responsable(s)
Notre recherche est liée à la pathophysiologie de deux Streptocoques majeurs, les Streptocoques des groupes A (SGA, Streptococcus pyogenes) et B (SGB, Streptococcus agalactiae), impliqués dans des infections invasives graves se déclarant pendant la grossesse ou la période néonatale.
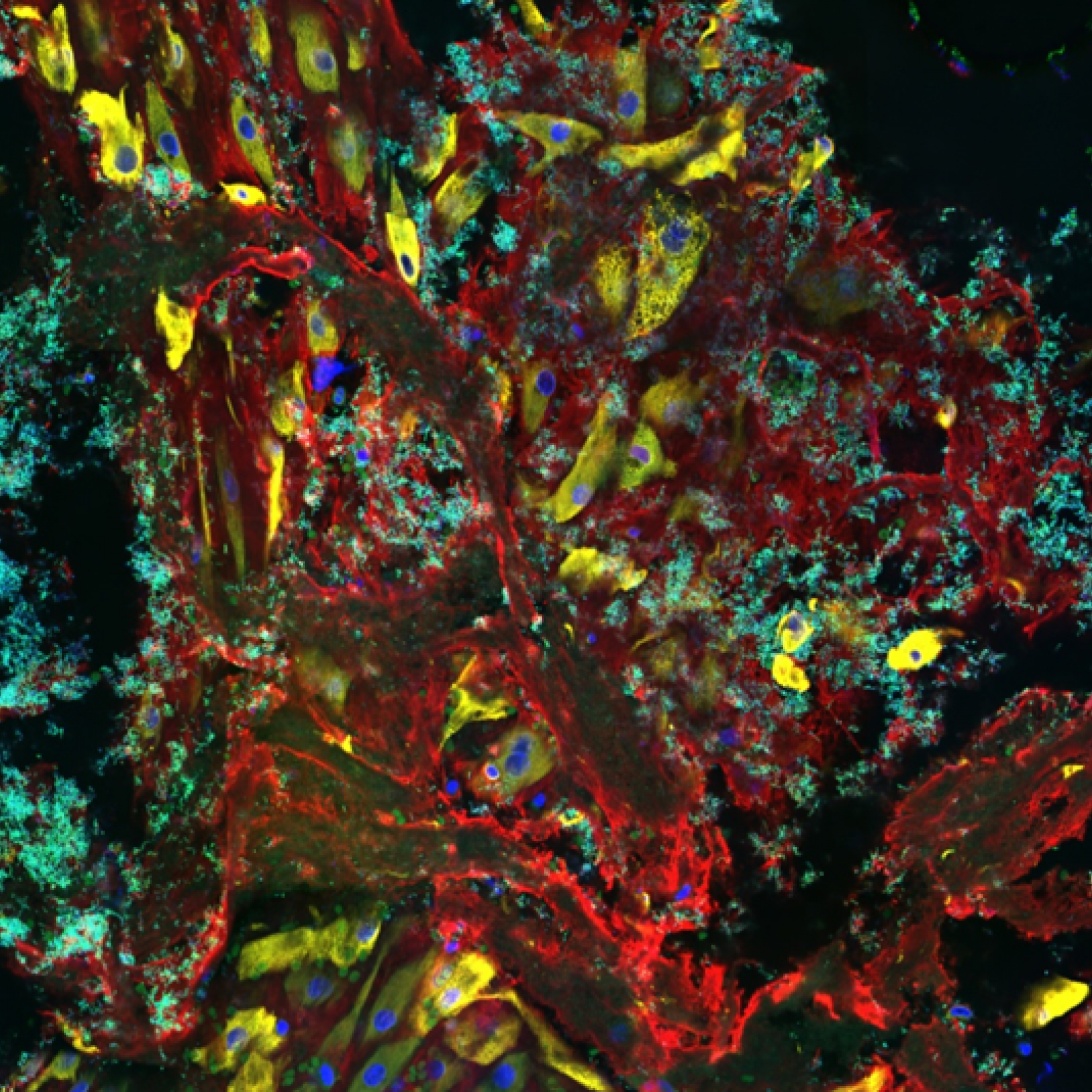
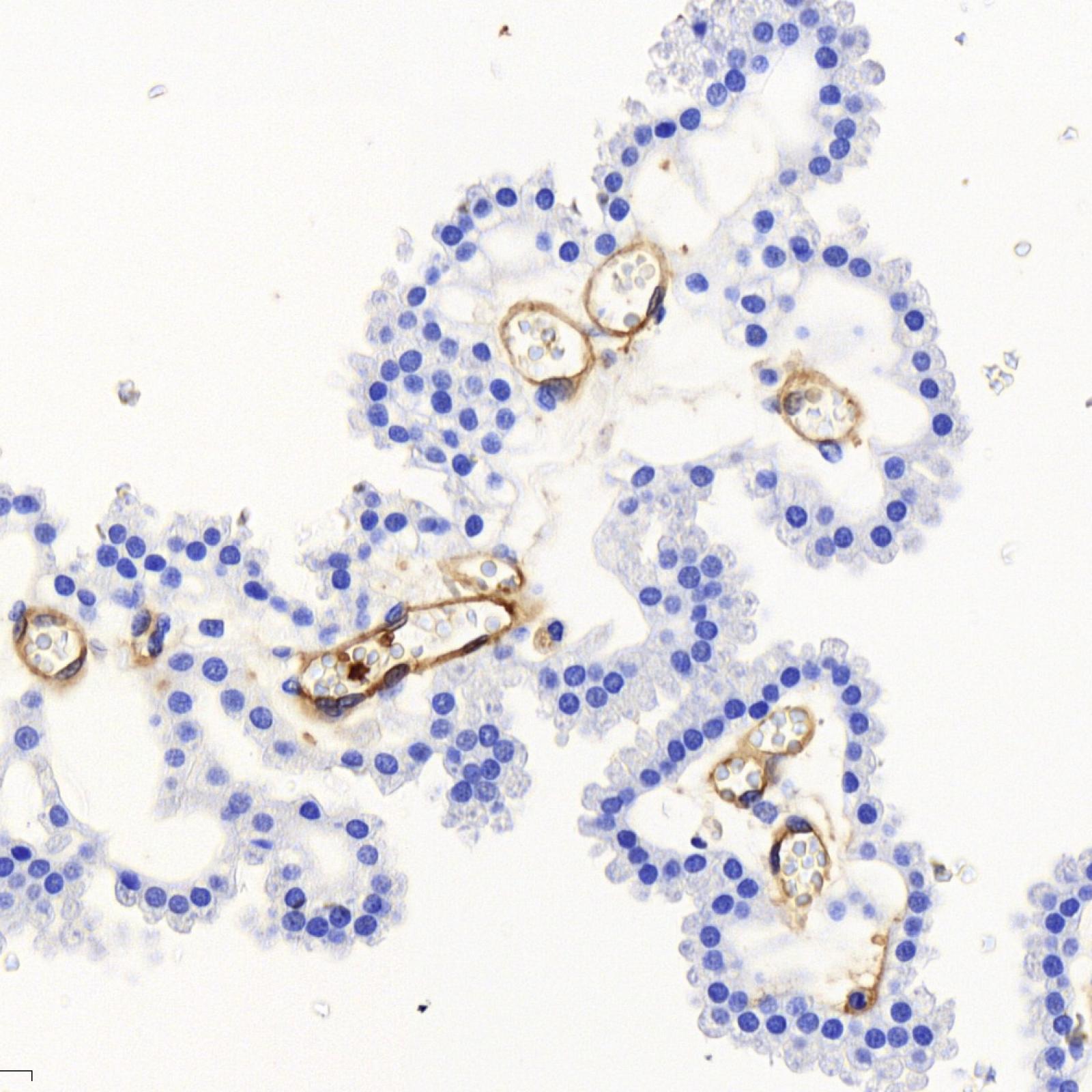
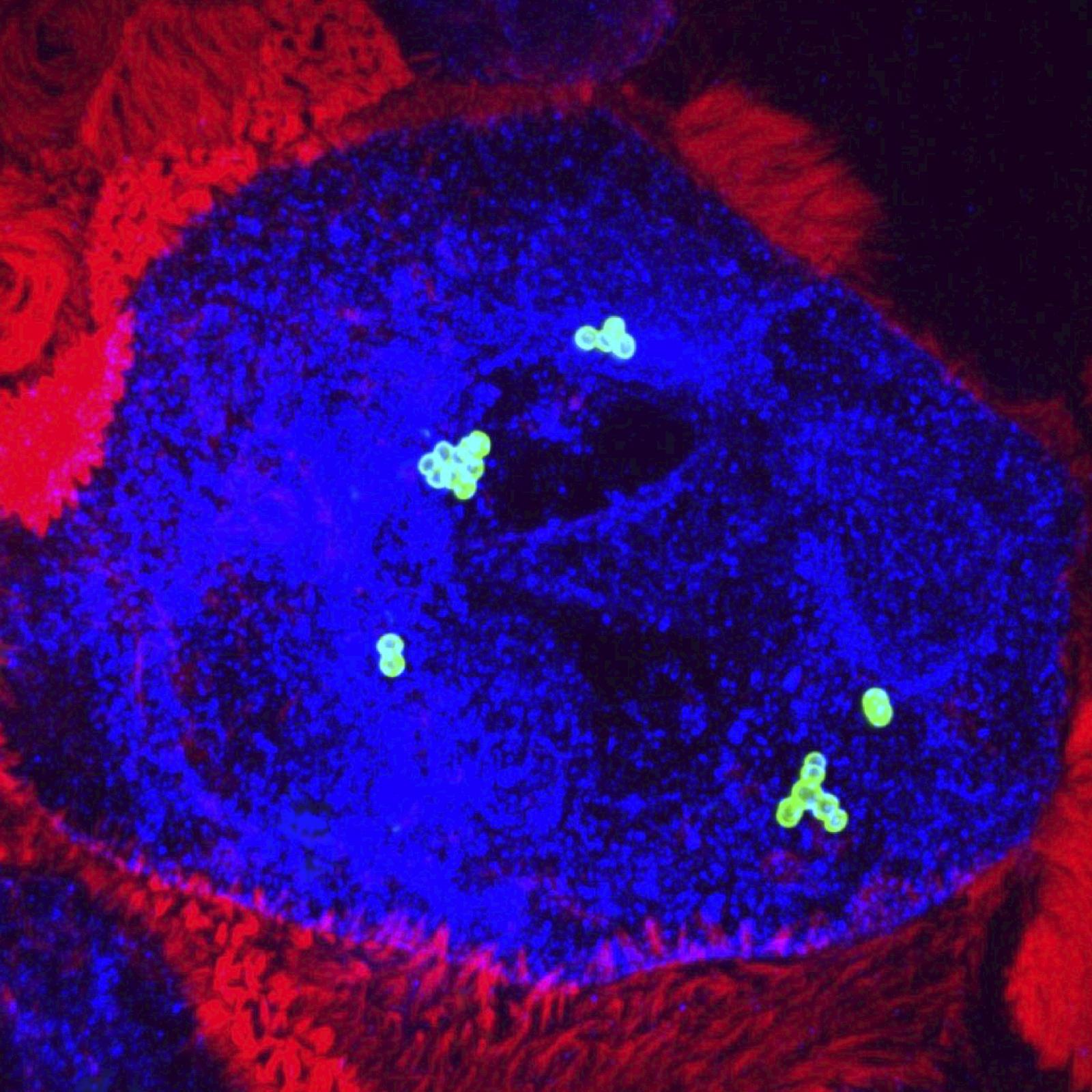
SGB appartient à la flore intestinale et vaginale de 10 à 30 % des adultes en bonne santé. Cependant, SGB est la principale cause d’infection néonatale. Notre but est de comprendre pourquoi une bactérie commensale chez l’adulte est un redoutable pathogène du nouveau-né. Nous identifions les mécanismes par lesquels SGB peut franchir des barrières physiologiques, digestives et hématoencéphaliques, et échapper au système immunitaire inné. Nous identifions les facteurs bactériens impliqués et les facteurs de l’hôte avec lesquels ils interagissent, ainsi que les prédispositions du nourrisson. Dans ce cadre, nous étudions la modification de facteurs cellulaires, la maturation de barrières physiologiques durant les premières semaines de vie et le microbiote du nouveau-né, en fonction de l’âge et de paramètres environnementaux tels que l’administration d’antibiotiques.
SGA est responsable d’infections légères, telle la pharyngite, ou sévères, tels la fasciite nécrosante, le syndrome de choc toxique streptococcique ou la fièvre puerpérale. Nous nous intéressons aux premières étapes des infections invasives qui impliquent l’adhésion au tissu, la croissance des bactéries à son contact et l’invasion de celui-ci. Là encore, les facteurs bactériens et cellulaires impliqués sont recherchés et la réponse immunitaire du tissu de l’hôte est analysée.
Enfin, Claire Poyart dirige le Centre National de Référence des Streptocoques (CNR-Strep) qui collecte les données cliniques envoyées par un réseau de laboratoires cliniques répartis sur l’ensemble du territoire national et caractérise au niveau moléculaire les souches responsables d’infections invasives et non-invasives.