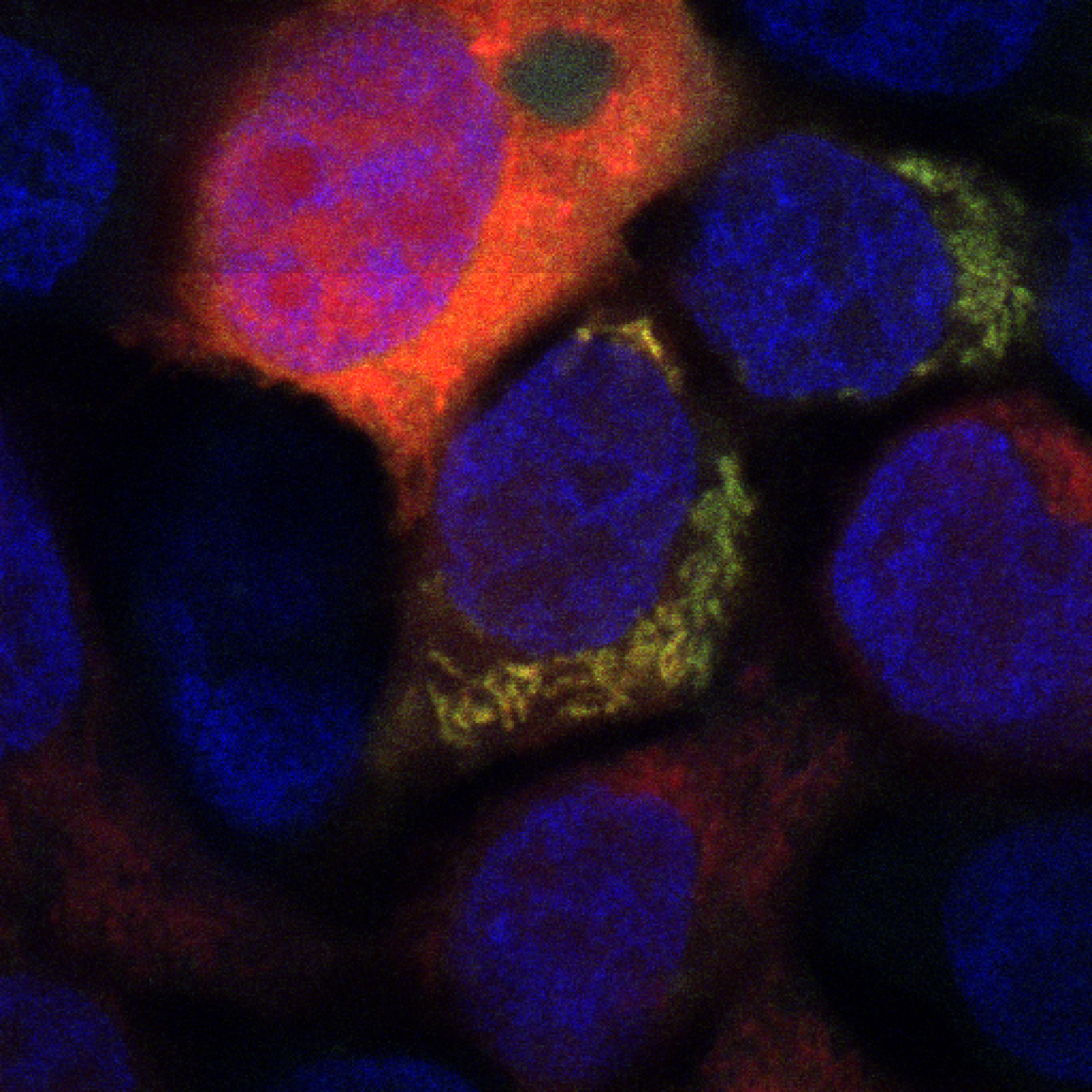
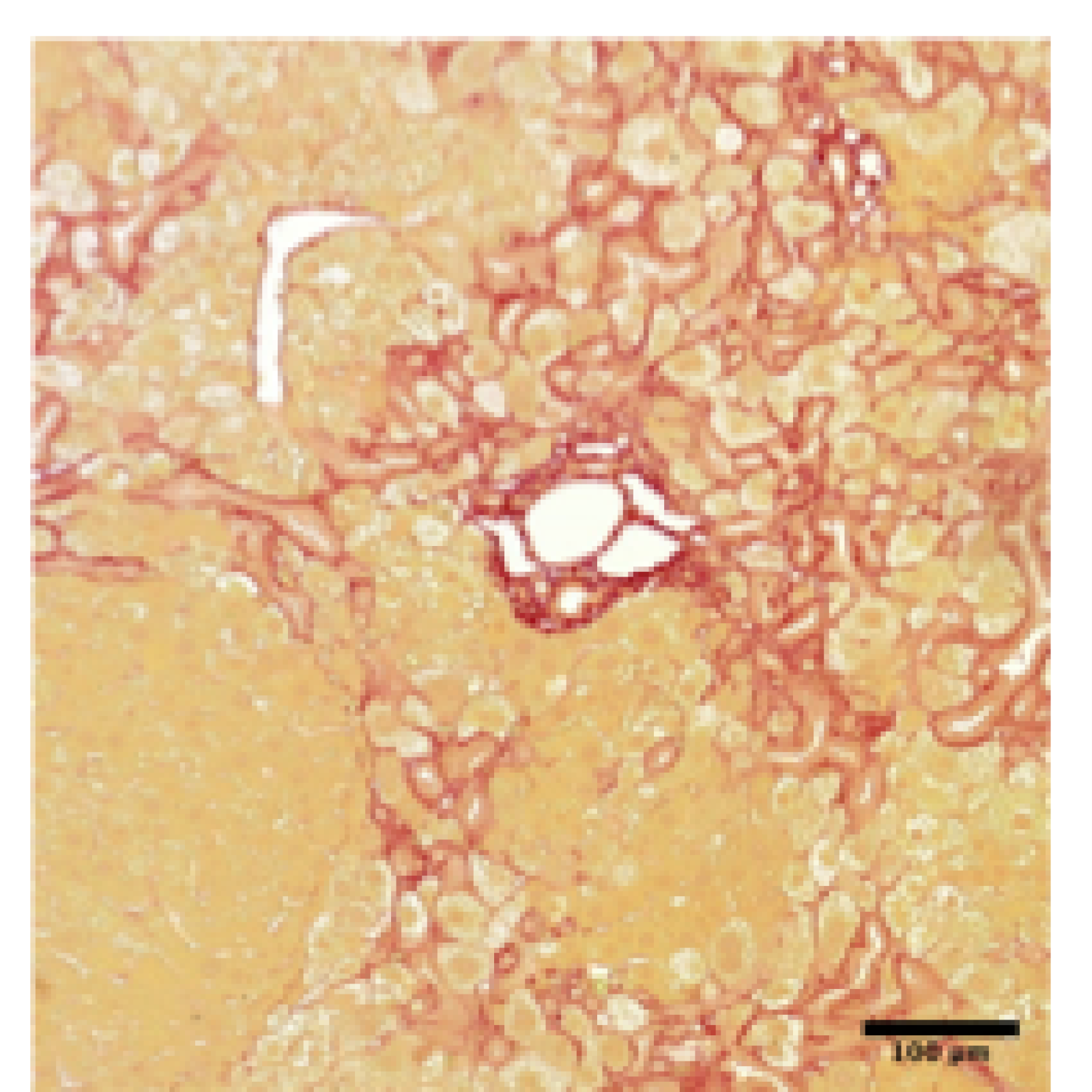
Signalisation du glucose et de l’insuline, glucotoxicité
L'intérêt principal de notre groupe est de caractériser les mécanismes moléculaires et biochimiques impliqués dans le contrôle du métabolisme intermédiaire par les nutriments et les signaux hormonaux dans les tissus participant à la régulation de l'homéostasie énergétique, en conditions physiologiques et physiopathologiques (diabète de type 2, glucotoxicité, NAFLD/NASH, maladies inflammatoires).
Actuellement, nous réalisons des études métaboliques et transcriptionnelles sur le rôle régulateur du récepteur de l'insuline (IR), de l'enzyme clé de la O-GlcNAcylation (OGT) et du facteur de transcription sensible au glucose ChREBP dans les cellules participant à la détection du glucose et/ou au maintien de l'homéostasie énergétique (hépatocytes, cellules épithéliales intestinales et cellules immunitaires). Nos objectifs scientifiques visent à comprendre comment IR, l’OGT et ChREBP modulent le dialogue inter-organes, en contrôlant le flux de glucose et/ou la sensibilité à l’insuline, mais aussi la libération de protéines systémiques (hépatokines, cytokines, peptides gastro-intestinaux), afin de contrôler finement l'homéostasie métabolique. Pour ce faire, nous tirons parti de modèles murins uniques développés par notre groupe dans lesquels nos cibles moléculaires sont invalidées génétiquement et spécifiquement dans nos tissus d’intérêt. Dans la mesure du possible, nous visons à valider nos études chez l’Homme, grâce à des collaborations cliniques (RHU-Quid NASH, Banque de tissus BioDIGE).
Nos principaux objectifs sont donc :
- d’étudier les relations entre la résistance intestinale à l'insuline, la fonction barrière de l’intestin et l'inflammation
- de comprendre le rôle de l'OGT dans les maladies hépatiques et inflammatoires
- d’explorer comment ChREBP affecte le dialogue inter-organes pour contrôler l'homéostasie énergétique.