Project members
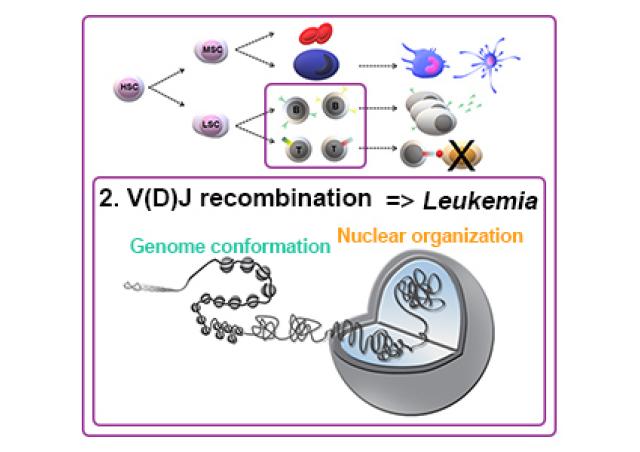
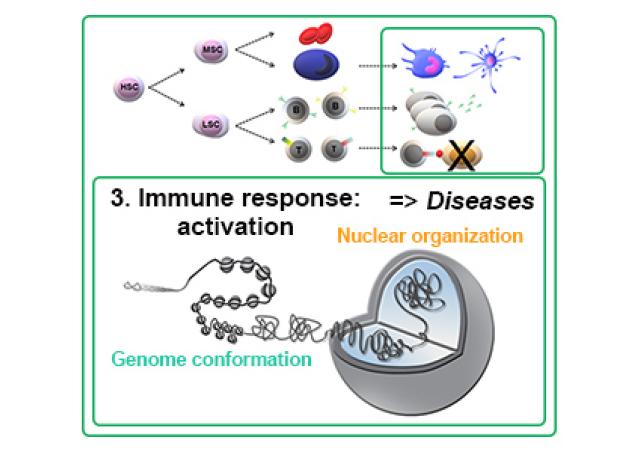
Nous nous intéressons au rôle de l’organisation du génome (de sa conformation 3D, à son environnement chromatinien et à sa localisation par rapport aux compartiments nucléaires) dans la régulation des programmes de différenciation hématopoïétique et comment sa dérégulation peut conduire à la transformation leucémique. Un nombre croissant de données confirme l'importance des modificateurs de la chromatine (1,2). De plus, la perturbation de la conformation 3D du génome, telle que la suppression ou la création d’éléments barrière de l’ADN, peut induire des altérations pathogéniques des interactions promoteur-enhancer (3,4). En particulier, les super-enhancers (SE) ont tendance à s'enrichir autour et à contrôler des gènes connus pour jouer des fonctions oncogéniques (5,6). La caractérisation des altérations de la conformation du génome, de nouveaux SE oncogéniques, de leurs gènes-cibles et de leur fonction est donc importante pour disséquer les mécanismes conduisant à la transformation oncogénique. Dans un projet collaboratif avec de Dr C. Lobry (Institut de recherche Saint-Louis, Paris, France), nous utilisons une combinaison d'analyses à l'échelle du génome, en particulier des approches de capture de conformation chromosomique, afin d'identifier des SE oncogéniques et de disséquer leurs gènes cibles et leurs fonctions dans la régulation des gènes et la progression leucémique. Une première étude collaborative avec les Dr C Lobry et T Mercher (IGR, Villejuif, France) a conduit à la découverte d'un nouveau SE (SEKIT) activant de manière coordonnée les gènes voisins, KIT et PDGFRA dans les cellules ETO2-GLIS2 AMKL (7).
1. Shih AH, Abdel-Wahab O, Patel JP, Levine RL. The role of mutations in epigenetic regulators in myeloid malignancies. Nat Rev Cancer. 2012;12(9):599-612.
2. Conway O'Brien E, Prideaux S, Chevassut T. The epigenetic landscape of acute myeloid leukemia. Adv Hematol. 2014;2014:103175.
3. Lupiáñez DG, Spielmann M, Mundlos S. Breaking TADs: How Alterations of Chromatin Domains Result in Disease. Trends Genet. 2016;32(4):225-237.
4. Fang C, Rao S, Crispino JD, Ntziachristos P. Determinants and role of chromatin organization in acute leukemia. Leukemia. 2020;34(10):2561-2575.
5. Sengupta S, George RE. Super-Enhancer-Driven Transcriptional Dependencies in Cancer. Trends Cancer. 2017;3(4):269-281.
6. Thandapani P. Super-enhancers in cancer. Pharmacol Ther. 2019;199:129-138.
7. Benbarche S, Lopez CK, Salataj E, Aid Z, Thirant C, Laiguillon MC, Lecourt S, Belloucif Y, Vaganay C, Antonini M, Hu J, da Silva Babinet A, Ndiaye-Lobry D, Pardieu B, Petit A, Puissant A, Chaumeil J*, Mercher T*, Lobry C*. Screening of ETO2-GLIS2-induced Super Enhancers identifies targetable cooperative dependencies in acute megakaryoblastic leukemia. Sci Adv. 2022;8(6):eabg9455. (*Co-senior authors)